汽车安全气囊化学反应_汽车安全气囊化学原理
1.轿车安全气囊化学原理 (详细点)
2.安全气囊利用的化学反应是什么?
3.小汽车在发生剧烈碰撞时,安全气囊会瞬间弹出,在0.01秒内引发下列化学反应:2NaN3+NH4NO3═3X↑+2Na+N2O
4.汽车中常配有一种汽车安全气囊,内部贮存有硝酸铵.当汽车高速行驶中受到猛烈撞击时,硝酸铵会迅速分解产
5.(1)汽车安全气囊中的填充物主要成分是NaN3、KNO3和SiO2.汽车发生猛烈碰撞时,NaN3分解,生成甲、乙两
6.高级汽车中常配置一种汽车安全气囊,内部贮存有硝酸铵(NH4NO3),当汽车高速行驶中受到猛烈撞击时,硝酸
7.汽车剧烈碰撞时安全气囊中发生反应
8.汽车安全气囊内有叠氮酸钠(NaN3)或硝酸铵(NH4NO3)等物质.当汽车受撞击时,这些物质会迅速发生分解反
轿车安全气囊化学原理 (详细点)
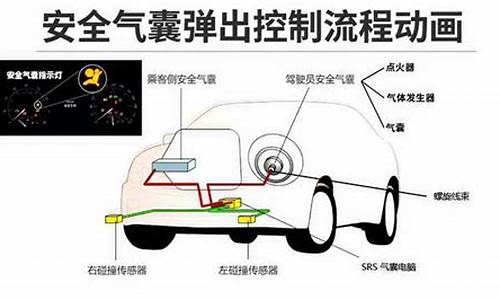
汽车安全气囊主要含有:叠氮化钠、硝酸钾和二氧化硅
2NaN3==(撞击)==2Na+3N2(气)
10Na+2KNO3+6SiO2====5Na2SiO3+K2SiO3+N2(气)
电子打火装置点燃叠氮化钠(化学分子式是NaN3)开始。这能使局部温度上升到300摄氏度,足以使大部分NaN3迅速分解。叠氮化钠燃烧产生出熔化的金属钠和氮气的混合物。然后,金属钠和硝酸钾反应释放出更多的氮气并形成氧化钾和氧化钠。这些氧化物会立即与二氧化硅结合,形成无害的硅酸钠玻璃
经过过滤的氮气充进了气囊
安全气囊利用的化学反应是什么?
编辑本段安全气囊的化学原理汽车的安全气囊内有叠氮化钠(NaN3)或硝酸铵(NH4NO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊。[叠氮化钠分解产生氮气和固态钠;硝酸铵分解产生大量的一氧化二氮(N2O)气体和水蒸气]新型安全气囊加入了可分级充气或释放压力的装置,以防止一次突然点爆产生的巨大压力对人头部产生的伤害,特别在乘客未佩戴安全带的时候,可导致生命危险。具体形式有:1.分级点爆装置,即气体发生器分两级点爆,第一级产生约40%的气体容积,远低于最大压力,对人头部移动产生缓冲作用,第二级点爆产生剩余气体,并且达到最大压力。总的来说,两级点爆的最大压力小于单级点爆。这种形式,压力逐步增加。2.分级释放压力方式,囊袋上开有泄压孔或可调节压力的孔,分为完全凭借气体压力顶开的方式或电脑控制的拉片Tether。这种方式,一开始压力达到设定极限,然后瞬时释放压力,以避免过大伤害。
小汽车在发生剧烈碰撞时,安全气囊会瞬间弹出,在0.01秒内引发下列化学反应:2NaN3+NH4NO3═3X↑+2Na+N2O
反应前钠原子的个数是2个,反应后是2个;
反应前氮原子的个数是8个,反应后应该是8个,其中6个包含在3X中;
反应前氢原子的个数是4个,反应后是4个;
反应前氧原子的个数是3个,反应后是3个;
由分析可知,每个X中含有2个氮原子,是氮气,化学式是N2.
故选:C.
汽车中常配有一种汽车安全气囊,内部贮存有硝酸铵.当汽车高速行驶中受到猛烈撞击时,硝酸铵会迅速分解产
(1)根据题意,硝酸铵受撞击后发生分解反应生成一氧化二氮气体和另一种氧化物,根据质量守恒定律,另一种氧化物是水,反应的化学方程式为:NH 4 NO 3
(2)铵根显+1价,氢元素显+1价,设铵根中氮元素的化合价为x,可得:x+(+1)×4=+1,x=-3. 硝酸根显-1价,氧元素显-2价,设硝酸根中氮元素的化合价为y,可得:y+(-2)×3=-1,y=+5. 氧元素显-2价,设一氧化二氮中氮元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:2z+(-2)=0,则z=+1. 故答案为:(1)NH 4 NO 3
|
(1)汽车安全气囊中的填充物主要成分是NaN3、KNO3和SiO2.汽车发生猛烈碰撞时,NaN3分解,生成甲、乙两
(1)叠氮化钠在放电条件下迅速分解生成甲、乙两种单质(由质量守恒定律,反应前后元素种类不变,两种单质应为钠和氮气),反应的化学方程式为:2NaN3
| ||
| ? |
氮气是空气的主要成分,不会对人体造成伤害;KNO3的作用是与可能会对人体造成伤害的单质甲(金属钠)反应,生成单质乙和两种氧化物;单质乙应为氮气,两种氧化物分别为氧化钠和氧化钾,反应的化学方程式为:10Na+2KNO3═K2O+5Na2O+N2↑.
(2)由质量守恒定律,化学反应前后,原子的种类及数目不变;在反应的方程式2FeTiO3+7Cl2+3C=2X+2FeCl3+3CO2中,反应物中有2个铁原子、2个钛原子、6个氧原子、14个氯原子、3个碳原子,生成物中有2个铁原子、6个氧原子、6个氯原子、3个碳原子,所以2X中有2个钛原子、8个氯原子,则1个X分子中有1个钛原子、4个氯原子,因此X的化学式为:TiCl4;TiCl4与氧气反应生成TiO2和氯气,反应的化学方程式是TiCl4+O2═TiO2+2Cl2.
故答案为:(1)2NaN3
| ||
| ? |
高级汽车中常配置一种汽车安全气囊,内部贮存有硝酸铵(NH4NO3),当汽车高速行驶中受到猛烈撞击时,硝酸
(1)硝酸铵受撞击时易分解产生一氧化二氮气体和水.该反应的化学方程式为:NH4NO3
| ||
| ? |
| ||
| ? |
(2)由于铵根显+1价,设氮元素的化合价为X:由X+(+1)×4=+1,解得X=-3,硝酸根显-1价,设其中氮元素化合价为Y:由Y+(-2)×3=-1解得Y=+5,设N2O中氮元素化合价为Z:Z×2+(-2)=0解得Z=+1.
故填:-3,+5,+1.
汽车剧烈碰撞时安全气囊中发生反应
此时发生化学反应产生氮气或一氧化氮气体(初中化学):
1、气囊中填充叠化钠:NaN3——Na +N2
2、填充硝酸铵 : NH4NO3——N2O+H2O
注意:
方程式未平衡
汽车安全气囊内有叠氮酸钠(NaN3)或硝酸铵(NH4NO3)等物质.当汽车受撞击时,这些物质会迅速发生分解反
(1)由题给的化学方程式可以知道,在反应物中含有2个Na,6个N,根据质量守恒定律的实质可以知道,在反应前后原子的种类和数目相等,所以反应后也应该出现2个Na,6个N,而反应后只出现了2个Na,所以在题中应该填写的内容为:3N2↑;
(2)NH4NO3中氢、氮元素质量比为:(1×4):(2×14)=4:28=1:7;
设铵根离子中氮元素的化合价为x,则根据原子团中正负化合价代数和等于原子团的化合价可以知道:
x+(+1)×3=+1,
所以x=-3,
即铵根离子(NH4+)中氮元素的化合价为-3价.
故答案为:(1)3N2↑;
(2)1:7;-3价.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












